国产ADC开年进展不断:罗氏10亿美元牵手本土药企,恒瑞获FDA快速通道资格
2024年开年,火热的抗体偶联(ADC)药物领域再迎来多个积极进展。

罗氏(Roche) IC 资料图
2024年1月2日,苏州宜联生物医药有限公司(简称“宜联生物”)宣布,已与知名跨国药企罗氏达成全球合作和许可协议,双方将合作开发靶向间质表皮转化因子的下一代ADC候选产品YL211,用于治疗实体瘤。
根据协议条款,罗氏将获得宜联生物YL211项目在全球范围内的开发、制造和商业化的独家权益。罗氏将向宜联生物支付首付款及近期里程碑付款5000万美元,另外还有近10亿美元的开发、注册和商业化潜在里程碑付款,以及未来基于全球年度销售净额的梯度特许权使用费。
同样是在ADC领域,2024年1月1日,恒瑞医药(600276.SH)公告称,近日收到美国食品药品监督管理局(FDA)的认证函,公司以HER3为靶点的ADC药物SHR-A2009获得美国FDA授予快速通道资格(FTD)。此次资格认证有助于加快药物后续研发和批准上市。
PD-1肿瘤药之后,ADC药物成为全球医药市场的宠儿。仅2023年,国产ADC海外授权交易就达到10余项。2024开年,一边是ADC的授权交易,一边是海外审批的积极进展,国产ADC的故事将继续吸引全球医药市场的瞩目。
靠在研ADC药物,宜联生物三个月内官宣与两家跨国药企的合作
在抗肿瘤方面,ADC药物兼具靶向药的方向感和化疗的强劲效果,有“魔法子弹”“生物导弹”之称。“不差钱”的跨国药企们也纷纷将目光瞄准了中国本土ADC在研药物。
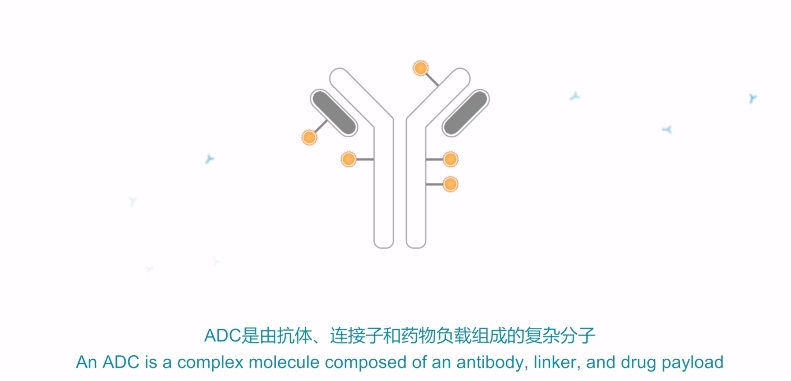
ADC的结构 来源:宜联生物官方微信公众号
罗氏原本是全球最早一批布局ADC领域的跨国药企之一,旗下的恩美曲妥珠单抗不仅是全球首个获批的单药治疗实体瘤的ADC药物,也是中国第一个乳腺癌领域HER2靶向ADC产品。2023年前三季度的全球销售额已超16亿美元。
此次罗氏看上的是宜联生物的YL211,这款ADC药物目前处于临床申报阶段。根据协议,宜联生物将与罗氏中国创新中心共同合作推动YL211项目进入一期临床试验阶段,并交由罗氏负责后续全球范围内进一步开发和商业化工作。
除了最新与罗氏围绕ADC的合作,宜联生物在2023年10月12日还曾宣布与全球mRNA明星公司百欧恩泰(BioNTech,Nasdaq: BNTX)达成战略合作和全球许可协议,双方将合作开发靶向HER3的下一代ADC候选产品,百欧恩泰将向宜联生物支付7000万美元首付款,以及额外开发、监管和商业化里程碑付款,潜在总金额超过10亿美元。
2023年12月15日,和铂医药(2142.HK)公告称,公司全资子公司诺纳生物(苏州)有限公司 (简称“诺纳生物”)与辉瑞收购的Seagen已就间皮ADC药物HBM9033的全球临床开发及商业化订立许可协议。根据协议,诺纳生物将获得5300万美元的预付款和近期付款,及最高达10.5亿美元的里程碑付款和特许权使用费。
值得一提的是,当天,宜联生物宣布其与诺纳生物签署一项补充协议,宜联生物和诺纳生物一致同意诺纳生物有权就双方共同开发的ADC产品HBM9033(YL215)许可给被许可第三方辉瑞,宜联生物有权基于诺纳生物与辉瑞合作获得一定比例的分许可分成。
海通国际此前研报指出,ADC药物是抗体及其偶联物的有机结合,国产厂商凭借工程师红利可获得相对竞争力。一系列ADC药物出海彰显国产ADC药物平台得到认可。国联证券研报认为,对于海外大药企而言,ADC产品与其自身管线布局战略契合度较高,能够填补产品组合空缺,通过license in(许可引进)可以很大程度上节省自身时间成本,从而以较低投入博取未来广阔的市场空间。
多款国产ADC近期获得FDA授予快速通道资格
通过授权交易将自家ADC产品带到国际市场,宜联生物称得上是国产创新药“借船出海”的典型案例。同样是在热门的ADC领域,“医药一哥”恒瑞医药则选择自主出海。
根据公告,此次被FDA授予快速通道资格的SHR-A2009于2021年进入临床研究,目前已经推进至Ⅱ期临床。其治疗实体瘤的国际多中心Ⅰ期临床研究正在中国、日本、韩国16家中心开展。截至目前,SHR-A2009相关项目已投入研发费用累计约4992万元。

恒瑞医药公告
除了恒瑞医药,复宏汉霖(2696.HK)的ADC药物此前也获得FDA授予的快速通道资格。2023年12月27日,复宏汉霖宣布,基于与宜联生物的合作,公司开发的EGFR靶向ADC注射用HLX42获得FDA授予FTD,用于治疗经第三代EGFR酪氨酸激酶抑制剂治疗后疾病进展的EGFR突变的晚期/转移性非小细胞肺癌。此前,HLX42用于治疗晚期/转移性实体瘤治疗的临床试验申请已经相继获得国家药品监督管理局、美国FDA许可。
FDA授予的快速通道资格认定适用于有潜力治疗严重疾病及解决重要未满足临床需求的药物,并给予促进开发和加快审评的政策支持,包括但不限于获得与FDA更多会议讨论、书面沟通的机会,从而在药物研发、临床试验设计等方面获得更加密切的指导;在符合相关标准条件时获得优先审评和加速批准;可通过滚动审评方式递交新药上市申报材料。
恒瑞医药在公告中表示,药物获得FTD后,公司将在后续的药物研发与审评过程中,获得更多与FDA沟通交流的机会。在药物研发早期阶段与FDA讨论在研药物的研发计划和数据,能够及时发现和解决研发中出现的问题,有助于加快药物后续研发和批准上市。
恒瑞医药董事、首席战略官江宁军表示:“SHR-A2009是恒瑞历史上第一个获得美国FDA快速通道资格认定的创新药。这个称号有助于加速SHR-A2009用于治疗重大疾病和解决未满足临床需求,也是对恒瑞ADC平台技术先进性与临床开发水平的认可。”复宏汉霖全球创新中心总经理单永强表示,此次HLX42获得FDA授予快速通道资格,标志着其在治疗重大疾病和未满足临床需求中的潜力得到认可。
